2018年10月18日
「Brush Up Study Vol.04 : ISO 15189 認定施設へのOne Point Information」を掲載しました。
- その他
要求事項
4.14.5 内部監査
検査室は,検査前,検査,検査後を含め,品質マネジメントシステムのすべての活動を判断するために
計画された間隔で内部監査を実施しなければならない:
a) この国際規格の要求事項及び検査室が確立した要求事項に適合する。
b) 実行され,効果的であり,維持管理されている。
解 説
内部監査を実施するための重要なポイントは、「監査プログラム」の策定と言えます。すなわち、組織において手順の遵守状況,目標(プロセスの意図した結果)の達成状況,是正処置の有効性の確認などの目的を設定して、ある期間内に監査する部署・手順・基準を明確にしたプログラムです。
まず、4.1~5.10の要求事項を担う部署(責任者)や関係する部署は、4.1.2.5 責任,権限及び相互関係で検査室管理主体により定義され、QMS機能組織図に記載された部署、組織及び責任者は、4.1~5.10の何れか、または複数の規格が要求する機能を担っているかに関与をしています。『品質マネジメントシステムのすべての活動を判断するために・・』 とあることから、①監査プログラムではこの関係を 『見える化』 する必要があります。次に注記1に 『内部監査のサイクルは,通常, 1年以内に完了することが望ましい』 とあることから、各被監査部署の監査時期を分散はしても1年以内に実施することです。
a) は国際規格の要求事項を満たしてQMSが構築され、②各プロセスが妥当性をもって展開されていることを検証します。また、国際規格でない検査室が自ら決定した要求事項が満たされていることを確認します。この検査室独自の要求事項の確認は、国際規格の適合性の監査を目的にした第三者では難しく、内部監査の重要な機能と言えます。
b) は内部監査の本質であり、展開された③各プロセスが効果的に実施され、意図した結果が達成されたことに基づき、4.2.1 一般要求事項“QMSは品質方針及び品質目標,ならびに利用者のニーズや要求事項を満たしたすべてのプログラムの完全性を提供している”ことを検証します。また、④4.10 是正処置のf) 講じた是正処置の有効性のレビュー、⑤ 4.1.2.4品質目標及び品質計画でQMSの変更に対する統合(完全に整った状態)された状態の維持管理の確認を行います。すなわち、内部監査は不具合を発見することよりも「QMSが効果的に実施され、維持されているか」を検証し、さらに監査を通じてQMSを効果的なものにする⑥4.15.3レビュー活動における改善のための機会としてとらえることで、発展的な内部監査に繋がっていきます。
理 論 編
解説の①~⑥までを「監査プログラム」として落とし込む具体的方法をこの理論編で説明します。まず、①について、4.1~5.10のプロセスと各部署、組織及び責任者との相互関係は、内部監査マトリクス(表1)を作成することで見える化を行います。
<表1>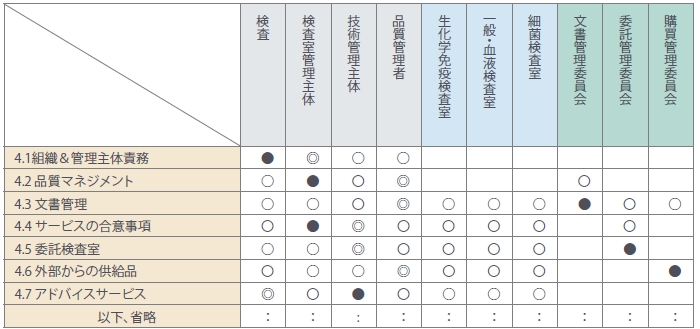
表1の「●」はプロセスオーナーであり、プロセスの規定や手順書を作成し、正しく機能させて意図した結果が得られるようにする責任と権限があります。また、「◎」はプロセスとの関連性が強く、「〇」は関与していることを示しています。内部監査では、「●」や「◎」は必須監査とし「〇」は必要に応じて又は毎回の内部監査ごとに被監査部署を変えて行います。
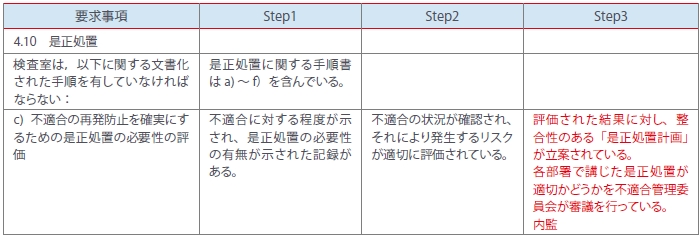
次にJABの「申請用チェックリスト(RFM-35)」をStep1~3のレベルのセルを作るようにアレンジします。そして、Step1は②の各プロセスの妥当性ある展開、すなわちQMS構築時あるいは初期運用時(初回審査)に監査する内容を検討して記載、Step2は③各プロセスの妥当性が確立され効果的な運用がなされている監査内容を検討し記載、さらにStep3は、⑥のプロセスの改善を促す監査内容を記載します。これら一連のStepを反映したサンプルを(表2)に示します。
<表2>

内部監査を行う場合に、自施設はStep1~3のどの監査レベルを行うべきかを検討し、チェックリストに落とし込みます。特にStep2の監査では、プロセスの有効性を検証するために遂行した活動の証拠(記録)や資料の内容が重要視されます。次に④の是正処置のレビュー(Follow Up)、⑤変更に対する統合性(変更・改訂によるレビュー)の確認は、表3を参考にしてチェックリストに書き加えます。
<表3>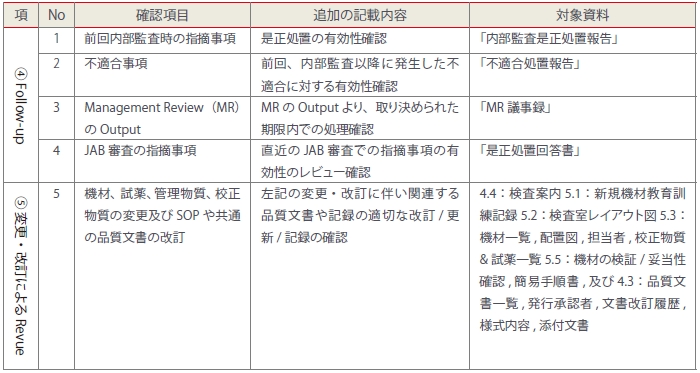
以上、①の内部監査マトリクスと②~⑥の要素を盛り込んだ内部監査チェックリストで行う監査プログラムを策定します。
実 践 編
理論編で示した「監査プログラム」を実際にFLS施設のQMSに導入し、検討しました。実践を試みたFLSのA認定施設は、1.約900床、2.特定機能病院、3.認定範囲 基幹項目1~6、非基幹項目 11~17、4.認定範囲の要員数約70人、5.認定取得後、約7年が経過という状況です。
まず、①内部監査マトリックスを作成しました(表4)。
<表4>内部監査マトリックス
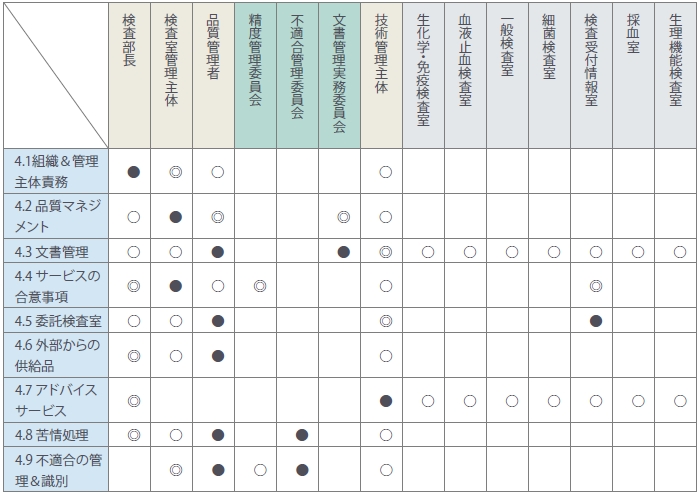
以下、省略
この表より規格項番が要求する機能と管理する・関わりが強い・担っている部署(者)との相互関係が明確となりました。また、各委員会を被監査側に加えたことでその意義が更に見える形となり、委員会活動の充実が期待できるようになりました。結果的に「的を得た監査内容を選択できる」仕組みが整備され、規格要求に漏れのない年間計画が作られています。
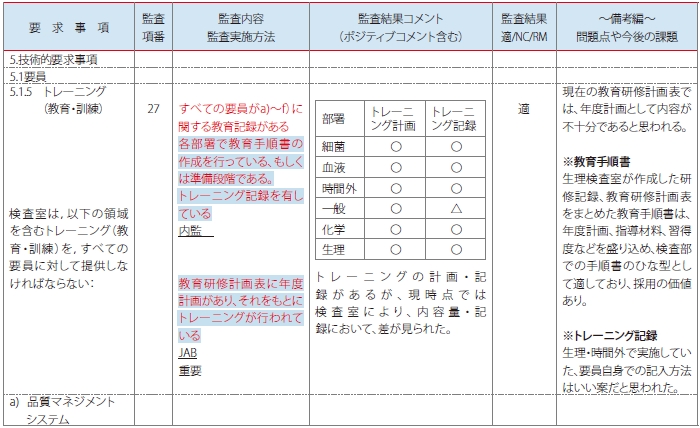
次にチェックリストを作成するにあたり、②,③,⑥の視点、すなわちStep1/2/3のレベルで要求事項を確認していくと、4.1.1.4検査部長のStep2で力量評価を示す監査が不十分であることが分かり、内部監査チェックリストに書き加えました(表5)。
<表5>

さらに4.4.1サービスの合意事項の確立では、Step1,2は以前の内部監査で実施済みのため、レベル3すなわち⑥改善の機会を検討し、チェックリストに書き加えました(表6)。
<表6>
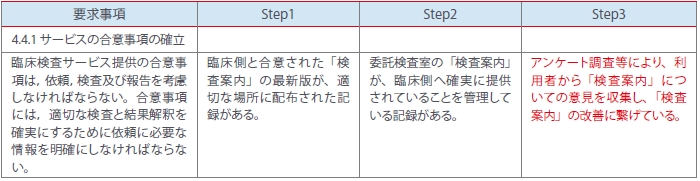
このように作成されたチェックリストに、④の是正処置のレビュー(FollowUp)、⑤変更に対する統合性(変更・改訂による
レビュー)の確認事項をいずれかのStepに加えます。
この時に、前回内部監査時の指摘事項を「内監」、内部監査以降に発生した不適合に対する有効性の確認は「不適合のNo.」、直近のJAB審査の指摘事項の有効性の確認を「JAB」、さらにマネジメントレビューのアウトプットの取り決められた期限内での処理確認を「MRアウトプット」と記号を加え、内部監査員が以前の状況を確認してから監査することができ、適切で有効性の高い監査が行える工夫がされました(表7)。また、前回の内部監査以降に改訂したSOPを(表3)に基づき、「⑤変更・改訂によるレビュー」を実施したところ、SOPのトレーサビリティ体系図や管理リストが最新版になっていないことが内部監査で発見されました。すなわち1つの品質文書の改訂により、影響を受ける他の品質文書の監査も同時に行われており、4.1.2.4 QMSを統合(QMSが完全に整っている状態)された状態を維持する指摘と言えます。根本的に今後の管理体制を改善する是正処置報告書をあげている状況が伺えます。
<表7>
さらに、監査スケジュールに従った現場監査は、各要員の業務時間を制約することから、日々作成する記録類以外は1か所に品質文書/記録類を集め、各監査員が時間に余裕があるときに、チェックリストに基づき監査を行い、現場でしか確認できないことだけをチェックリストに残すことで、中身の濃い内部監査を実施することができました。
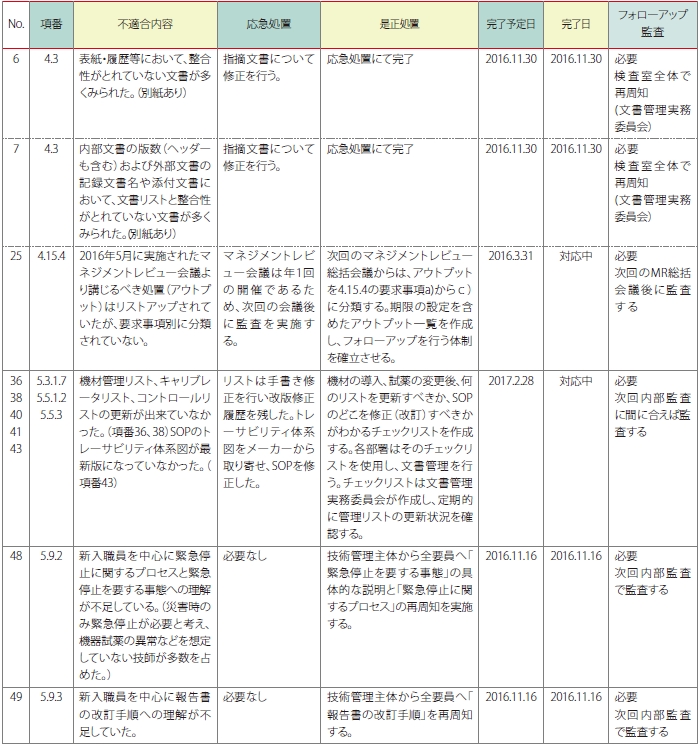
今回の内部監査では全49項目の監査結果に対し、NCが5件とRMが4件を見出しました。この指摘事項に対し、この施設では、チェクリスト記録をさらにアレンジして、チェックリストと結果報告書を共通した書式とし、監査内容、方法、結果、問題点、課題を系統的な一連の表記による「結果報告書」に仕上げる工夫をしています。この方法は報告書の作成の作業効率を改善し、規格要求から監査の結果及び問題点や今後の課題までが理解しやすく、監査員間での共有化を図ることに有効な方法であると言えます(表8)。
この結果報告書は12名の内部監査員が作成され、この監査結果を基に内部監査報告会ではQMSの課題を見出す検討が行われており、監査員の力量アップに有効な教育・訓練となっています。
監査日時 :2016.11.2~7
監査院(委員会):●●●●、●●●●、●●●●
被監査部門(者):各検査室
<表8>
また、是正処置報告書を一元管理するための一覧表を作成し、不適合に対する適切な処置が迅速に講じられ、遅滞なく是正処置が講じられているかをレビューしています(表9)。
<表9>
結論として、今回の試みによる新たな監査プログラムの作成によって、効率的で効果的な内部監査が実施されました。さらに、監査プログラムだけにとどまらず、監査報告書や是正処置に至る一連のプロセスが改善される結果となりました。この施設では、JABによる審査では今回、作成したチェックリストと同じ質問が審査員からあり、その有効性を実感したとのことでした。現在、各FLSの施設ではQMSの継続的改善を止めることなく、更なる内部監査のプロセスの改良が行われています。
引用文献:資料
1)Future Lab Session in OSAKA 第4回 ブラッシュアップセミナー
2)ISO 15189:2012 英和対訳版(一般財団法人 日本規格協会 出版事業部)
3)ISO 9001:2008を正しく理解しよう 著者 加藤重信 (東京電気大学出版局)
監修:Future Lab Session in OSAKA 世話人会
発行:ベックマン・コールター株式会社
- PDF版ダウンロードはこちら
- ダウンロード
