2020年10月22日
「Brush Up Study Vol.06 : ISO 15189 認定施設へのOne Point Information」を掲載しました。
- その他
要求事項
4.15.2 レビューへのインプット
マネジメントレビューへのインプットには, 少なくとも以下の評価の結果からの情報が含まれていなければならない。
※ a) ~ o)
解 説
上記の規格要求事項は4.15マネジメントレビューにある項番です。ISO 9000:2005の用語における「3.2.3 品質マネジメントシステム(QMS)」の定義は『品質に関して組織を指揮し,管理するためのマネジメントシステム 』 です。
4.15.1一般では、検査室管理主体がこのQMSについて「継続した適格性,妥当性,有効性,かつ患者ケアを支援していることを確実にするために」 レビューすることを要求しています。
すでにQMSを導入している施設では、QMS活動で日常的な業務の結果報告や課題は、各ミーティング・管理者会議及び各委員会等においてリアルタイムで検討され、処理が行われる組織構造(組織文化)がQMS機能組織図からも構築されていることから、マネジメントレビューの重要な機能の1つは、日常的な業務の裏に潜む各システムの「悪さ加減」を検査室管理主体がリーダーシップを持ってレビューする機会を提供することです。
そこでマネジメントレビューへのインプットでは、日常の結果報告や課題の振り返り情報を収集したインプットではなく、検査室管理主体が上記4点(適格性,妥当性,有効性,患者ケア)についてレビューし、QMSの各システムを改善する必要性を判断できる 『情報やデータの分析結果』を収集し、マネジメントレビュー会議に提供することが必要となります。よって4.15.2レビューへのインプットの要求事項に「以下の評価の結果からの情報が含まれる」と記載しているのは、a)~o)に関するQMS活動におけるパフォーマンス(実施状況/実績)を上記4点の観点で関係要員が評価した結果をインプットの責任者がまとめた上、マネジメントレビューが実施されるべきであることを言外に示しています。
解 説
QMSの各システムを改善する必要性を検査室管理主体が判断できる 『情報やデータの分析結果』をより効果的に、また、効率的に収集し、さらに情報に漏れがないように実施できるインプットの仕組みを理論編で検討してみます。
まず、ISO 15189:2012の4.2品質マネジメントシステム 4.2.1一般では「検査室は,この国際規格の要求事項に従って,品質マネジメントシステムを確立し,文書化し,実行し,維持管理しなければならない。また、その品質マネジメントシステムの有効性を継続的に改善しなければならない。」と要求しています。マネジメントレビューは、正にこのQMSの有効性を継続的に改善するための重要な機能であると言えます。
また、この4.2.1の要求事項ではQMSを確立し, 文書化することを要求していますが、これは検査室が国際規格の要求事項に従って品質マネジメントシステムの全体を規定する 『品質マニュアル』 を最上位文書とし、具体的な規定/規則、さらに手順書を下位文書として構成された文書体系を確実にすることを求めています。
なぜ、QMSで文書体系を確実にすることが重要なのでしょうか? それは、検査室がQMSを構築する段階で国際規格を満たしながら自施設の実運用に適した品質文書を作成し、体系化した仕組みが、4.1.2.4 品質目標及び品質計画に記載された要求事項(4.2品質マネジメント)を満たすために策定された「品質マネジメントシステムの計画」そのものを示しているからです。
すなわち、QMS構築で作成された一連のプロセスを組み合わせた全体構造を1つの大きな「システム」として考えた場合『確立された文書体系』は、このシステムのPDCAサイクルにおける “Plan” としての機能を果たすことを意味しています。そして、このPlanが実行された結果 “Do” は、達成した結果を記述した、または実施した活動の証拠を提供する文書としての 『記録』 によって客観的に評価できる情報に変換されます。
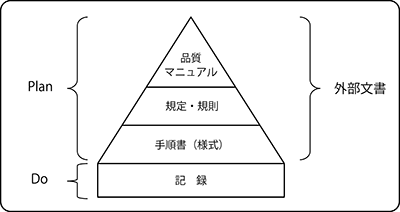
文書体系
そして、この大きな「システム」のCheck機能が内部監査とマネジメントレビュー(MR)であり、Action機能が内部監査での修正/是正処置、及びMRのアウトプットということになります。従って、インプットを作成する材料は、文書体系に基づいて作成された品質文書と客観的に評価できる情報(記録)、または分析結果であることが導き出せます。
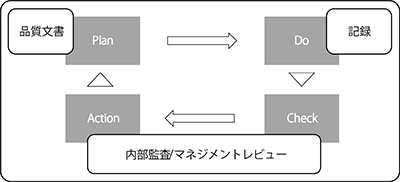
QMSを1つの大きなサイクルと考えた場合のPDCAの概念図
注記: 4.8苦情処理 4.9不適合の識別及び管理 4.10是正処置までの一連のプロセスは、QMS活動において偶発的に発生する事象に対するシステムであり、内部監査やマネジメントレビューのように計画的にCheckやActionを実施することを国際規格では要求していないことに留意する。
そこでQMSが継続した適格性,妥当性,有効性,かつ患者ケアを支援していることを確認するために、上記のインプットの材料を以下の表Aの視点で評価します。
<表A>
- (説明)
- ① 本来は国際規格を深く読み込み、要求事項の意図を規定・規則/手順書に刷り込み、同時に実運用に見合ったものを作成することが理想的ですが、要求事項の意図が適切に反映されておらず実運用とのそごや手順内容に過不足が発生している可能性があります。特に他施設の品質文書やコンサルタントの資料をそのまま流用した場合は、このようなことが起こる可能性があります。
- ② 検査室では作成された規定・規則/手順書に従って業務が実施されますが、現状の作業量に対し作業工数が多く非効率的な手順になっている、作業者の力量規程が甘く成果物にばらつきがある、前後の作業工程とのバランスが取れておらず効率的な作業になっていない、手順書にない作業が時々発生するので手順の追加が必要である、管理者の要員への教育/指導力が弱く作業ミスが発見されるなどの客観的に評価できる情報(記録)、または分析結果を基に評価します。
- ③ ①②の評価よりQMS活動の結果が、規定・規則/手順書(計画)から期待した結果に比べてどの程度達成されたかを評価します。また、同時に達成された結果と使用された資源との関係、すなわち「効率性」もQMSの維持継続という側面において評価することも範疇に入れておきます。
- ④ ③の評価を基に検査室のQMS活動が、患者及び検査室サービスの利用者のニーズを満たすことにどのように関わり、また、貢献しているかを評価します。
以上、①~④までの各段階の評価において必要に応じて改善提案を追加することが重要であり、これは、4.15.2レビューへのインプットが要求する “評価の結果からの情報が含まれる”について意図するところの1つです。
これで、QMSを改善する必要性を検査室管理主体が判断できる 『情報やデータの分析結果』を収集する考え方が明確化されました。次に、この考え方を基に効果的で効率的な方法で、さらに情報に漏れがないようにインプット資料を作成するための具体的な方法を検討します。
4.15.2レビューのインプットでは、a)~o)までの項目についての評価の結果からの情報を要求しています。そこで、a)依頼,手順の適格さ,サンプル(試料)要求事項の定期的レビューを例として、この項に関係する「規定・規則/手順書」を品質文書一覧(文書体系)から抽出し、国際規格の要求項番に割り振って整理します。また、同様にこれらのa)の項目に関連した記録類も同様に行います。
(例) 【規定・規則/手順書(計画)】
5.2 施設及び環境条件・ ・・・・・・・・・・・・・・・・・・・・・・環境管理規定
5.3 検査室の機材, 試薬, 及び消耗品・ ・・・・・・・・・・機材/消耗品管理手順書
5.4 検査前プロセス・ ・・・・・・・・・・・・・・・・・・検査前手順書、検査案内
5.5 検査プロセス・ ・・・・・・・・・・・・・・・・・・・・標準作業書規定、SOP
(例) 【記録類(実績/証拠資料)】
5.2 施設及び環境条件・ ・・・・・・・・・・・・・・・・・残余検体の二次利用記録
5.3 検査室の機材, 試薬, 及び消耗品・ ・・・・・・・・・・・機材/消耗品管理記録
5.4 検査前プロセス・ ・・・・・・・・・・受入不可検体記録、検査案内レビュー記録
5.5 検査プロセス・ ・・・・・・・・・・・・・標準作業書規定&SOPのレビュー記録
記録類は、振り返りの記録としての資料とするのではなく、上記、表Aの評価項目で検討材料となりそうな記録の抽出、及び収集記録から統計処理や傾向及びパターンの情報に編集してインプットの材料とすることがポイントです。
また、a)~o)項目のインプットの責任者(検査室管理主体、品質管理者、技術管理主体、各部署管理者、各委員会責任者等)を定め、項目ごとにレビュー対象の期間、記載日、責任者、部署、実績の概要(関連項番)、実績を踏まえた評価の結果(適格性、妥当性、有効性、患者ケアの支援)の欄を含む枠組み(インプット・シート:表B)を作成し、必要な情報を記入して①~④の評価を行います。
<表B> インプット・シート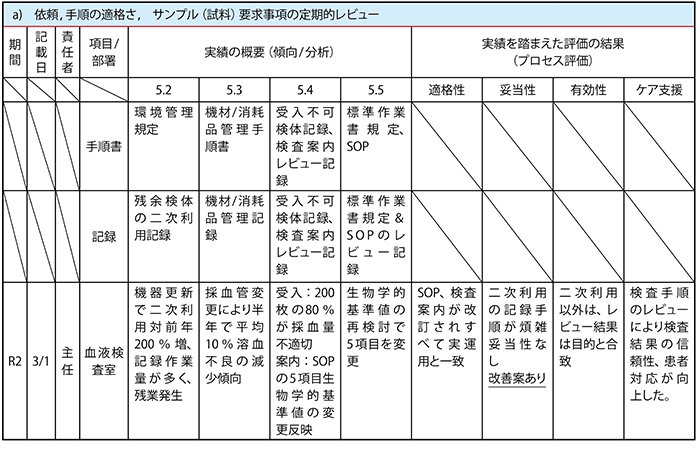
以上、このインプット・シートをa)~o)の各項目に対して1枚作成することで、QMSの各システムを改善する必要性を検査室管理主体が判断できる 『情報やデータの分析結果』 をより効果的に、また、効率的に収集を行い、さらに情報に漏れがないインプット資料が作成されます。さらにQMSのすべてに関するマネジメントレビューを行うために、4.15.2レビューのインプットのa)~o)までの項目では、抽出されない可能性がある規定・規則/手順書や記録類を考え、次の3項目を追加します。
【追加項目】
p) 品質方針・品質目標(4.15.3)
q) 教育訓練(5.1)
r) 委託検査室(4.5)
4.3 文書管理と4.13記録の管理はQMS活動の全体に関連することからd)内部監査で扱うことにします。さらに日常のミーティングや会議録を精査し、a)~r)の各項目に関連する議題の記録文書を抽出して客観的に評価できる情報(記録)、または分析結果に加えることで漏れのないインプット・シートを作成することができます。
最後に「内部監査」と「マネジメントレビュー」は、QMS活動が計画に従って実施され、その結果は有効性をもって達成されていることを目的とした監査、またはレビューするプロセスであることは同じですが、その目的が少し異なっていることについて説明します。
国際規格の4.14.5内部監査の主語は “検査室” になっています。すなわち検査室の要員である品質管理者や内部監査員によって定期的に内部監査は実施され、QMSのすべての活動を判断するために実施することで「QMS範囲(内部)の課題」を把握し、検査室管理主体はその監査結果の報告を受ける内部目的のための監査です。
一方、4.15マネジメントレビューの主語は “検査室管理主体”となっています。この規格文書では、検査室管理主体が自身の責任として定期的にQMS全体のレビューの実施を要求しています。そこには「QMS範囲の内部の課題」だけでなく、上位組織や社会情勢の変化による「外部の課題」も把握した上でQMSのレビューが求められています。なぜならQMS組織における検査室管理主体は、臨床検査運営委員会や施設経営者層、あるいは行政機関等の外部からQMSの活動状況について説明責任を求められる立場にあるからです。
そのためQMSの品質方針についても、検査室を包含する親組織の経営方針の変化とその整合性、施設利用者の患者層の変動、臨床側のニーズの変化等も踏まえて変更の必要性についてマネジメントレビューで討議する必要があります。また、品質目標も品質方針との整合性が4.1.2.4品質目標及び品質計画で要求されています。それ故、4.15.3レビュー活動では、品質方針及び品質目標の変更の必要性の評価を要求しています。
以上の考察結果から4.15.2のレビューのインプットの項目には、品質方針の変更の必要性や品質目標の達成度の結果に対する情報は要求していませんが、マネジメントレビューでは品質方針及び品質目標との関連におけるQMSの妥当性を評価することから、今回のインプット・シートの提案にインプット項目として品質方針・品質目標を追加しています。
実 践 編(※ 特定機能病院、 一般病床:500床以上、JAB認定取得施設)
『4.15マネジメントレビュー』の規格要求事項を踏まえ、理論編に基づき当検査部で作成した新様式のインプット・シートから得られたマネージメントレビュー(MR)会議で必要となるインプット資料を前年度まで使用していたインプット資料と比較し、評価を行いました。
1.従来のインプット資料
1)従来のインプット資料が出来上がるまでのステップ

2)問題点
- (1) MR会議を1年の総決算と位置づけ、全部門がa)~o)全ての要求事項に対して何らかの報告書を提出していました。そのため、単なる報告事例が多く(約250事例)、その確認にもかなりの時間を費やしていました。
- (2) a)~o)の要求事項に見合った内容で書かれてはいましたが、問題点へのアプローチの方法に一貫性がみられず、本質に迫った内容で書かれていませんでした。そのため、MR会議では問題事例の多くで的確な指示を出すことができていませんでした。
- (3) 資料作成等に費やす時間の割に、MR会議で「QMSのどこに問題があるのか」、「どこを改善する必要があるのか」が、不明確な状態で非効率でした。
-
<表1> 討議資料例(討議後指示含む)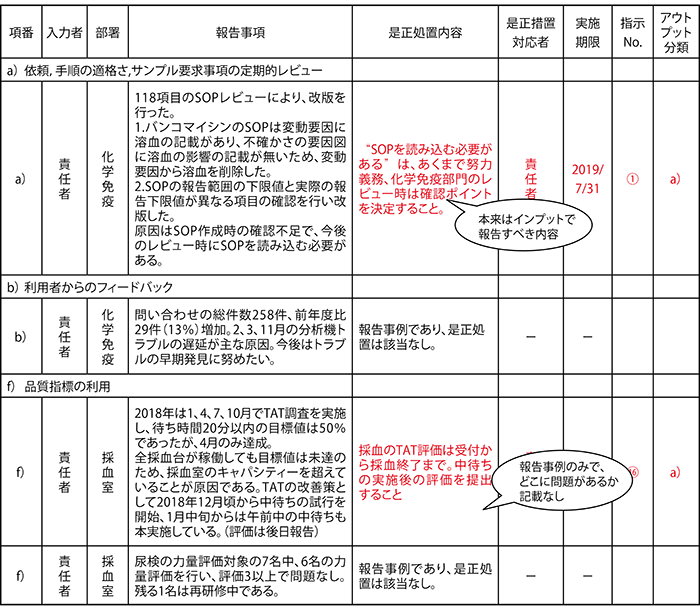
- (4) MR会議での指示事項も実施期限までの計画が曖昧なこともあり、期限までに完了しない事例や期日延長願いを提出している事例が34%(2018年度)で、その対策が急務でした。(図1)
<表2> 補足資料例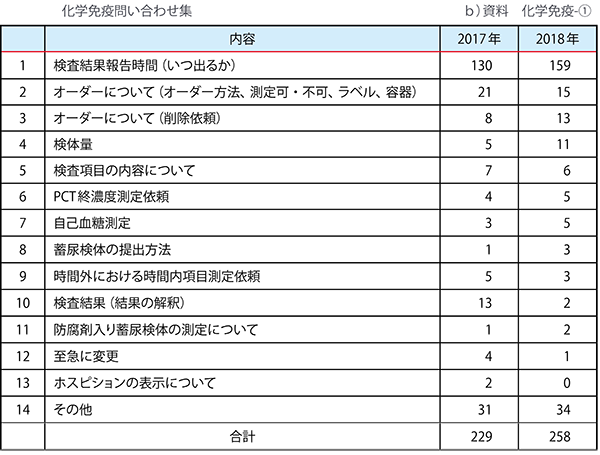
<図1> 2018年度MR進捗状況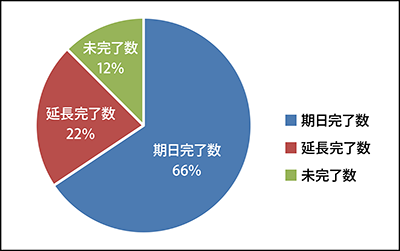
2.新様式のインプット・シートの導入までの道のり
1)基本となるインプット・シートの準備からインプット資料作成まで

2)問題点と苦労した点
- (1) 基本シートの作成には文書体系に基づいて作成された品質文書と客観的に評価できる記録や分析結果が必要となってきますが、新たに作られた記録類の一部が、文書体系から漏れていたことが分かり、再度確認作業が必要となりました。このような漏れを無くし能率よく作業にあたるには、常日頃から品質文書一覧への追加修正を意識して作業を行う必要があります。今回、責任者レベルでも「文書管理に対する意識付けに課題あり」という問題が浮き彫りになりました。 また、文書体系を理解した上で、上位文書から各部門の手順書や記録類への流れを基本シートに記載してもらいたかったのですが、基本シートを作成した意図がうまく伝わっておらず、理解されるのに時間がかかりました。
- (2) 基本シートの概説だけでは十分な理解が得られていないと考え、当検査部の過去の事例に当てはめて例を作成しました。事例を交えて説明を行うことで『適格性の維持』、『妥当性の確認』、『有効性の判断』、『患者ケアの支援』の関連性を十分理解してもらえると思っていましたが、提出されたインプット・シートから理解度に差がみられました。
- (3) 提出されたインプット・シートは例年通り修正や追加が必要でした。また、適格性、妥当性、有効性に整合性のないインプット・シートが多くみられました。
3.新様式のインプット・シート作成上で見えてきた効果や課題
1)効果
- (1) ISO 15189に求められている要求事項の項番とMRで要求されているa)~o)の項目の関連性が整理できることで、部門が報告すべき要求項番が明確になります。また、報告者も報告事例を整理する上でISO 15189が求めている要求内容を意識するようになります。
- (2) 手順書と記録の関係性を理解する事は、必要な手順や無駄な記録などが明確になります。そのため、不足していた手順の追加や記録の統合が行えます。
- 2)課題
- (1) 『適格性の維持』、『妥当性の確認』、『有効性の判断』、『患者ケアの支援』について、大筋では把握していますが十分とは言えません。基本シートの説明を受けた者個人が、理解力を上げることはもちろんのこと説明者も受講者のレベルに合わせてわかりやすく説明することができるスキルが必要です。
- (2) 『有効性の判断』、『患者ケアの支援』では、関連文書も記録も整っていて一見すると要求事項に対して『有効』であるようにみえます。しかし、取られている記録自体の評価次第で更なる改善点が必要となるのか、あるいは『有効でない』となるかの判断に苦慮する事例がありました。施設で統一した見解が必要となってくると思います。
<表3> マネジメントレビュー(インプット)関連項番マトリクス表
2019年度MR会議 インプット資料作成担当部門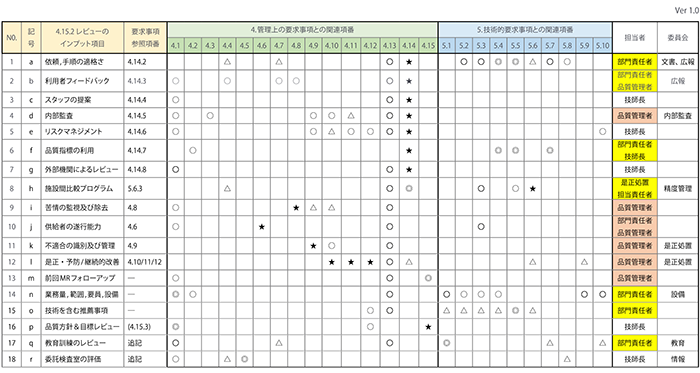
★:規格要求「4.15.2 レビューへのインプット」に記載の参考項番
◎:関連性の高い項番
〇:関連性のある項番
△:実績状況により、関連する項番
<表4> マネジメントレビュー インプットシート
様式番号:MR-01-Ver.01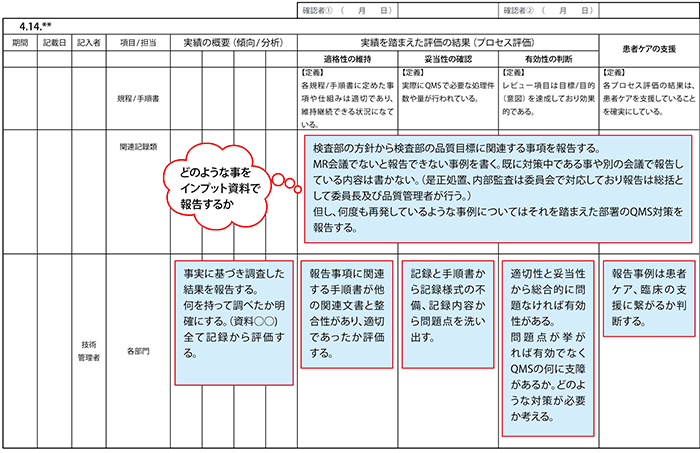
<表5> マネジメントレビュー インプットシート様式番号:MR-01-Ver.01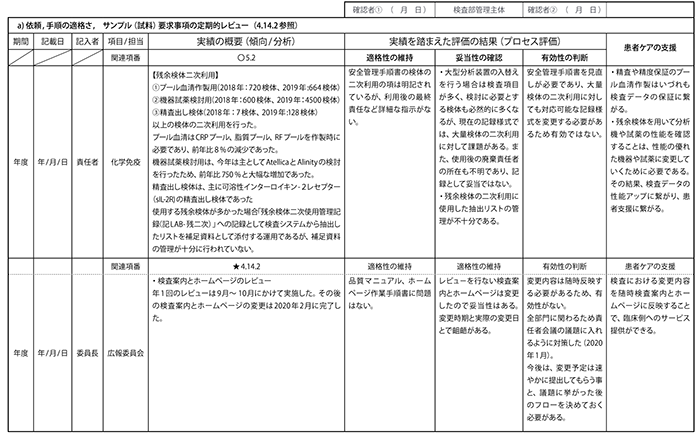
4.新様式のインプット・シート作成上で見えてきた効果や課題
従来の様式では報告することに重きが置かれていたため、検査部内の問題点が分かりづらい状態でした。新様式のイン プット・シートを使用することでISO 15189の要求事項に基づいた評価が可能となり、患者ケアに至るまでの方向性を定めたことで問題点が明確になりました。
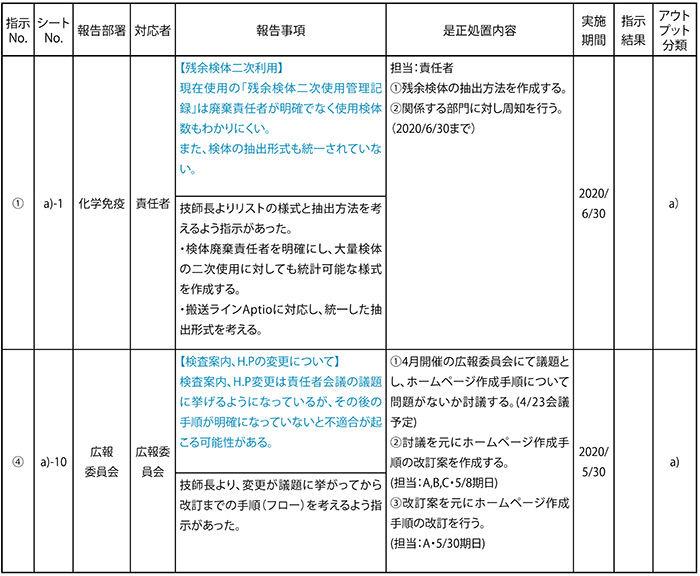
問題点を明確化にすることは改善のための実施計画を詳細に立てることができ、期日管理も確実に行うことができます。(表6)
<表6> MR進捗指示リスト
作成日: 年/ 月 /日
作成者: 品質管理者
5.まとめ
『適格性の維持』、『妥当性の確認』、『有効性の判断』、『患者ケアの支援』の関連性を頭の中ではわかっているつもりでも、実際にインプット・シートに起こすことは難しく、関連性を理解した上で使用することが必要です。
今回は、新様式のインプット・シートの説明からシート提出までの期間が約1か月と短時間であったこともあり、提出されたインプット・シートには、従来の報告形式(内容)が一部混在していました。報告事例は、担当部門を決めたことで前年度252事例から50事例とかなり絞ることができ、項目もa)~o)(追加として、p)~r))を網羅することができました。
新様式のインプット・シートは、ISO 15189の要求事項を適格に網羅できており、記録を有効に用いることで客観的評価が可能です。また、QMSの維持管理を行うMR会議へのふさわしいインプット資料となります。さらにISO 15189の項番別に評価が行えているので、内部監査への活用も有効と考えます。
参考文献
1. ISO 15189:2012 「臨床検査室-品質と能力に関する要求事項 第3版 (英和対訳版).日本規格協会
2. ISO 9001:2008 (JIS Q 9001:2008) 要求事項の解説 第1版.日本規格協会
3. ISO 9001:2015 (JIS Q 9001:2015) 要求事項の解説 第1版.日本規格協会
4. 2008年版対応 ISO 9001 新・解体新書 初版. 日刊工業新聞社
5. 2015年版対応 ISO 9001 要求事項の解説とマネジメントシステム構築の仕方 第1版.日科技連出版
監修:Future Lab Session in OSAKA 世話人会
発行:ベックマン・コールター株式会社
- PDF版ダウンロードはこちら
- ダウンロード
MAPSS-DX-202009-001
