前立腺がん診断能の向上に向けて -phi の有用性と今後の展望- こちら
第61回日臨技中部圏支部医学検査学会 ランチョンセミナー6を収録した講演動画となります。
新規保険適用! 2021年11月1日より
アクセス ハイブリテックp2PSA*

はじめに
前立腺特異抗原(PSA)のうち、遊離PSA(free PSA, 以下 fPSA)のいくつかのアイソフォームはPSAの前駆体(proPSA)であり、その中でも[-2]proPSAは腫瘍抽出物中で最も多く検出され、前立腺癌組織で良性組織に比べて強く免疫染色されるため、注目を集めています1,2。また、[-2]proPSAは特定されている5種類のproPSAの中でもっとも安定しています3,4。 「アクセス ハイブリテックp2PSA」* は 、血清中の[-2]proPSA濃度を測定する試薬です。
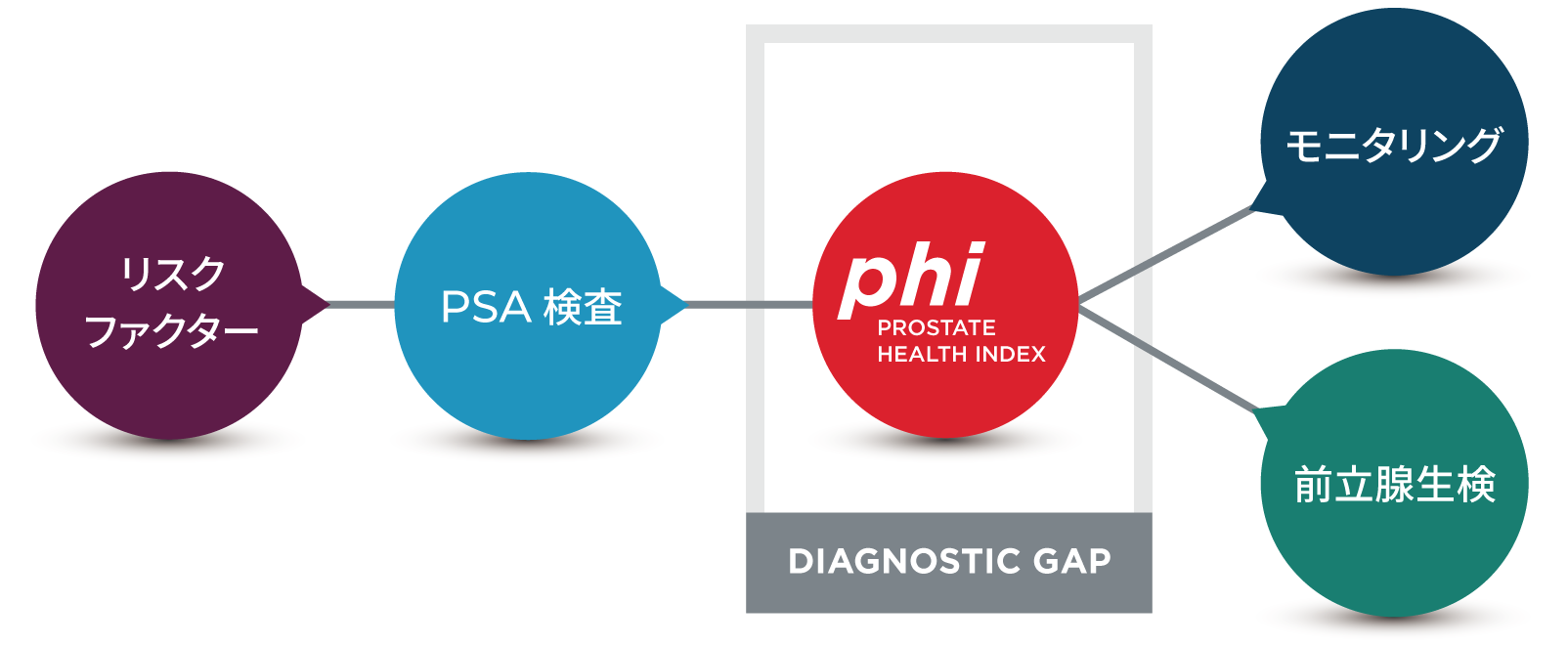
プロステートヘルスインデックス(phi )とは?
「アクセス ハイブリテックp2PSA」* は 、「アクセス ハイブリテック PSA」 および「アクセス ハイブリテック freePSA」とともに用い、その結果からプロステートヘルスインデックス(phi )(以下「phi 」)と呼ばれるインデックスを求めます。
| phi は、前立腺がん診断のための新たなマーカーです。 phi が、「前立腺癌診療ガイドライン 2023年版 1. 診断に関するアルゴリズム」に掲載されました! →<診断に関するアルゴリズム>図を掲載したリーフレットはこちら |
本品の臨床的有用性は、本品による[-2]proPSA値に「アクセス ハイブリテック PSA」 による PSA値及び「アクセス ハイブリテック freePSA」による free PSA値を用いて算出するBeckman Coulter Prostate Health Indexにより認められています。そのため、 PSA値及びfree PSA値は、別売の「アクセス ハイブリテック PSA」及び「アクセス ハイブリテック freePSA」※ を用いて測定する必要があります。演算式は以下のとおりです。
![]()
※ 製造販売承認番号:20500AMY00118000
〉 phi は前立腺癌リスクを判定するための補助手段として、感度および特異度が最適になるように考案されました。
〉 前立腺癌の腫瘍マーカーとしてはPSAが広く用いられますが、4~10 ng/mLのグレーゾーンの際に、phi はそのPSA値の示唆する癌のリスクや生検で発見される癌の確率などについて、より正確な情報を提供できる可能性があります5,6,7。
〉 PSAグレーゾーン領域群の生検陽性率は30程度(PSA 4.0~10.0 ng/mL)と報告されている8 ため、 Bootstrap法を用い、168 例の非癌患者と72例(30%)の前立腺癌患者を本製品臨床性能試験対象より復元抽出する、というランダムサンプリングを1000回繰り返し、phi と前立腺癌確率(平均値および95%信頼区間)を算出しました(下表)。
phi の層別解析による前立腺癌確率(%)
| 方式 | 前立腺癌確率(%) | 95% 信頼区間(%) |
|---|---|---|
| 0~ 25.0 | 8.0 | 2.0 ~ 15.7 |
| 25.0 ~ 36.0 | 21.2 | 13.3 ~ 29.5 |
| 36.0 ~ 55.0 | 36.0 | 28.2 ~ 44.4 |
| 55.0+ | 71.6 | 56.3 ~ 86.4 |
【保険適用の概要】
| 項目 | 測定方法 | 保険点数 |
| D009 腫瘍マーカー プロステートヘルスインデックス(phi ) |
化学発光酵素免疫 (CLEIA)法 |
281 点 |
○ 留意事項 プロステートヘルスインデックス(phi )
ア 診療及び他の検査(前立腺特異抗原(PSA)等)の結果から前立腺癌の患者であることが強く疑われる者であって、以下の(イ)から(ハ)までのいずれかに該当する者に対して、CLEIA法により、前立腺特異抗原(PSA)、遊離型PSA及び[-2]proPSAを測定し、プロステートヘルスインデックス(phi )を算出した場合に限り算定する。
(イ) 前立腺特異抗原(PSA)値が 4.0ng/mL 以上かつ 10. 0ng/mL 以下
(ロ) 50 歳以上 65 歳未満であって、前立腺特異抗原(PSA)値が 3.0ng/mL 以上かつ 10.0ng/mL 以下
(ハ) 65 歳以上 70 歳未満であって、前立腺特異抗原(PSA)値 3.5ng/mL 以上かつ 10.0ng/mL 以下
イ ア に該当する患者に対して、前立腺癌の診断の確定又は転帰の決定までの間に、原則として1回を限度として算定する。ただし、前立腺針生検法等により前立腺癌の確定診断がつかない場合においては、3月に1回に限り、3回を限度として算定できる。
ウ 「D009」腫瘍マーカーの前立腺特異抗原(PSA)を併せて実施した場合には、主たるもののみ算定する。
エ 「D009」腫瘍マーカーの遊離型PSA比(PSA F/T比)を併せて実施した場合には、主たるもののみ算定する。
オ 本検査を算定する場合は、診療報酬明細書の摘要欄に、前立腺特異抗原(PSA)の測定年月日及び測定結果を記載すること。また、本検査を2回以上算定する場合は、診療報酬明細書の摘要欄にその必要性を記載すること。
【臨床性能試験】 (添付文書より)
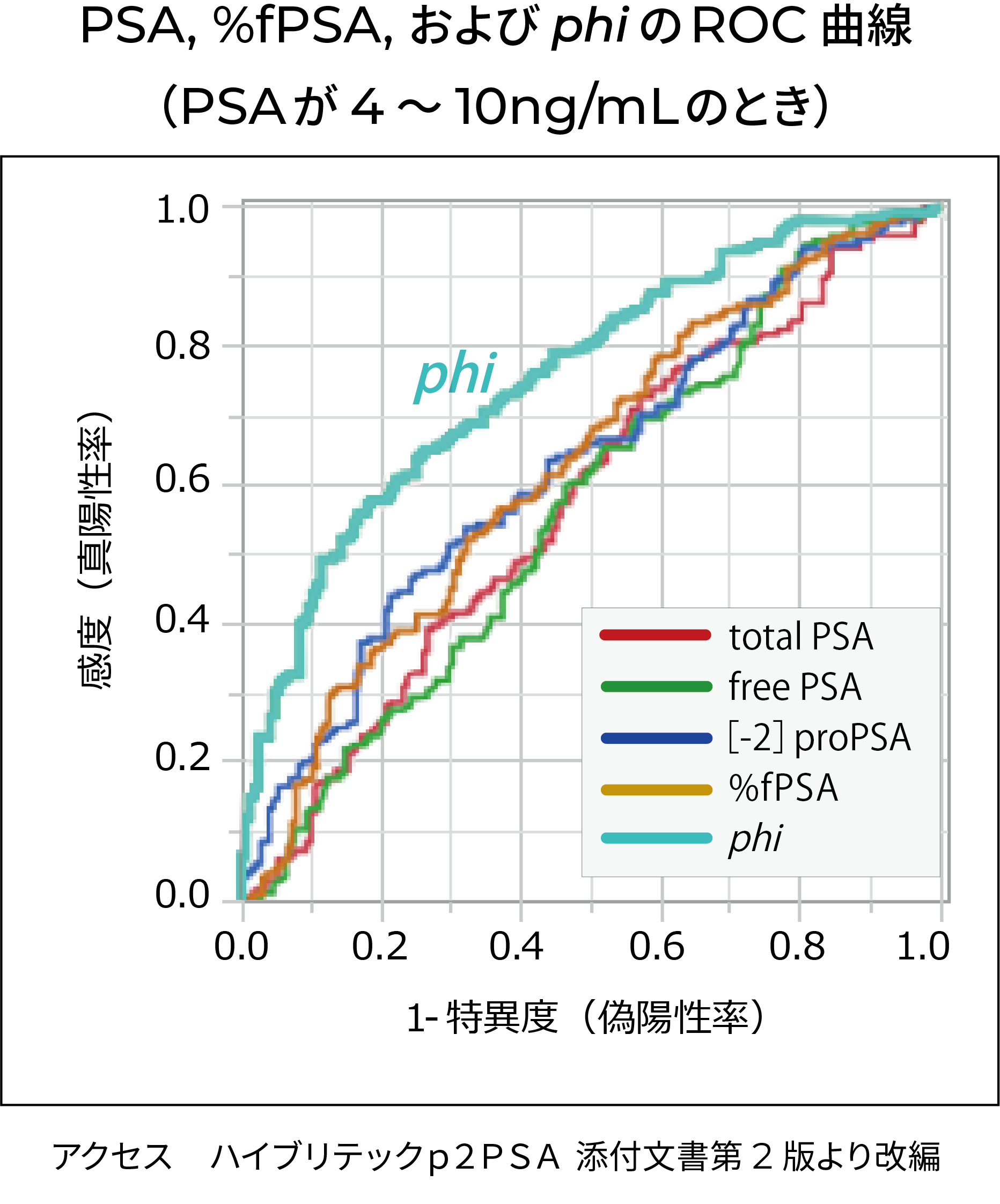
国内において50~79歳の血清PSA値が 4.0ng/mL 以上あるいは年齢階層別PSA基準値上限(50~64歳:3.0 ng/mL 、65~69歳:3.5 ng/mL 、 70歳以上: 4.0ng/mL)以上、かつ10 ng/mL以下となり前立腺癌が疑われる363例の男性を対象に多施設共同研究が実施され 、[-2]proPSA関連インデックスphiの診断精度を既存補助診断マーカーの癌診断精度の評価が行われました。ROC解析の結果、phiのROC曲線は全領域で既存補助診断マーカーと交差せず、常により感度が高い位置にあり、AUCもphi が最も高値で した 。
PSA, %fPSA と phi のAUC (PSAが4~10 ng/mLのとき)
| PSA | free PSA | [-2]proPSA | %fPSA | phi | |
| AUC | 0.572 | 0.567 | 0.626 | 0.629 | 0.759 |
| 95% 信頼区間 |
0.509 -0.632 |
0.505 -0.628 |
0.564 -0.684 |
0.568 -0.687 |
0.704 -0.806 |
| p値※ | <0.0001 | <0.0001 | <0.0001 | 0.0002 | - |
※: phi のAUCと比較したときのp値
アクセス ハイブリテックp2PSA 主な仕様
| 検体種/検体量 | 血清 / 50μL |
|---|---|
| 測定時間 | 約20分 |
| 測定範囲 | 0.50 ~ 5,000pg/mL |
| 開封後試薬安定性 (開封後, 2~10℃) |
28日間 |
| キャリブレータ安定性 | 開封前は-20℃以下で保存、 開封後は2~10℃で60日間 |
| キャリブレータ有効期間 | 28日間 |
測定に必要な試薬
(このほか、アクセス ハイブリテック PSA、アクセス ハイブリテック freePSA試薬が必要です)
| 製品名 | 内容 | 製品番号 | JAN CODE | 貯法 | 法区分 |
| アクセス ハイブリテックp2PSA 試薬パック* |
50テスト ×2 | A49752 | 4987666206754 | 2~10℃ | 体外診断用医薬品 |
| アクセス ハイブリテックp2PSA キャリブレータ |
7レベル × 2.1mL × 1 | A49753 | 4987666206761 | -20℃以下 | - |
| アクセス ハイブリテックp2PSA QCセット |
3レベル × 5.0mL × 2 | A56934 | 4987666206396 | -20℃以下 | - |
*体外診断用医薬品(30200EZX00002000)
【参考文献】
- Mikolajczyk SD. Proenzyme forms of prostate-specific antigen in serum improve detection of prostate cancer. Clin Chem 2004 March;50:1017-1025.
- Chan TY, Mikolajczyk SD, Lecksell K, et al. Immunohistochemical staining of prostate cancer with monoclonal antibodies to the precursor of prostate-specific antigen. Urology 2003; 62: 177-81.
- De Vries SH, Raaijmakers R, Blijenberg BG, et al. Additional use of [-2] precursor prostate-specific antigen and “benign” PSA at diagnosis in screen-detected prostate cancer. Urology 2005; 65: 926-930.
- Semjonow A, Kopke T, Eltze E, et al. Pre-analytical in-vitro stability of [-2]proPSA in blood and serum. Clinical Biochemistry 2010; 43: 926-928.
- Le BV, Griffin CR, Loeb S, et al. [-2]Proenzyme Prostate Specific Antigen in more accurate than total and free prostate specific antigen in differentiating prostate cancer from benign disease in a prospective prostate cancer screening study. J of Urolgy 2010; 183: 1355-1359.
- Jansen FH, van Schaik RHN, Kurstjens J, et al. Prostate-specific antigen (PSA) isoform p2PSA in combination with total PSA and free PSA improves diagnostic accuracy in prostate cancer detection. European Urology 2010; 57: 921-927.
- Catalona WJ, Partin AW, Sanda MG, et al. A multicenter study of [-2]pro-prostate specific antigen combined with prostate-specific antigen and free prostate-specific antigen for prostate cancer detection in the 2.0 to 10.0 ng/mL prostate-specific antigen range. J Urology 2011 May;185:1650-55.
- Ito K, Ohi M, Yamamoto T, Miyamoto S, Kurokawa K, Fukabori Y, Suzuki K, Yamanaka H The diagnostic accuracy of the age adjusted and prostate volume adjusted biopsy method in male with prostate specific antigen levels of 4.1-10.0 ng/mL Cancer 95 2112 2119 2002
- Ito K, et al. Diagnostic Impacts of Clinical Laboratory Based p2PSA Indexes on any Grade, Gleason Grade Group 2 or Greater, or 3 or Greater Prostate Cancer and Prostate Specific Antigen below 10 ng/ml J of Urology 2020; 203: 83-91
※ 本ページに掲載されている情報は、医療関係者の方々を対象にしたものです。



